Investigadores estadounidenses y españoles han descubierto ahora que al menos algunas bacterias pagan un alto precio por su resistencia: un costo que quizá podamos aprovechar para combatir las infecciones.
«Hemos descubierto un talón de Aquiles de las bacterias resistentes a los antibióticos», afirma el biólogo molecular Gürol Süel de la Universidad de California en San Diego.
«Podemos aprovechar este costo para suprimir el establecimiento de resistencia a los antibióticos sin medicamentos ni productos químicos dañinos».
Al explorar por qué las bacterias con factores de resistencia no necesariamente dominan a sus parientes no resistentes, la bióloga Eun Chae Moon de la Universidad de California en San Diego y sus colegas descubrieron un ejemplo de protección que tiene un costo: impide la capacidad de las bacterias de sobrevivir cuando los niveles de magnesio son bajos.
«Si bien a menudo pensamos en la resistencia a los antibióticos como un beneficio importante para la supervivencia de las bacterias, descubrimos que la capacidad de hacer frente a la limitación de magnesio en su entorno es más importante para la proliferación bacteriana», explica Süel .
La privación de magnesio de los entornos podría contrarrestar la capacidad de las bacterias para prosperar. Y como las cepas no mutadas no comparten el mismo defecto, la reducción del nutriente clave no debería afectar negativamente a las bacterias necesarias para un microbioma saludable.
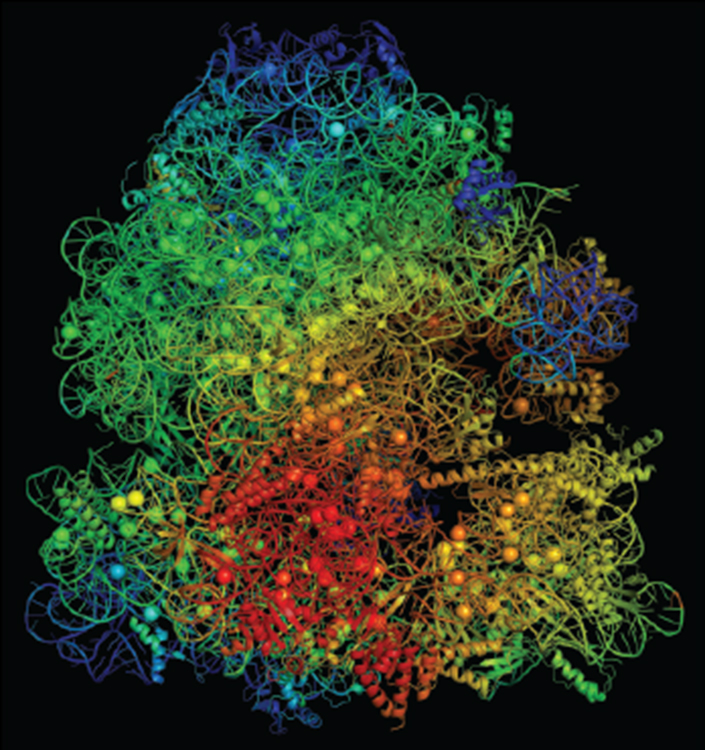
Los metales cargados, como los iones de magnesio, estabilizan los ribosomas , las micromáquinas de las células que crean proteínas. Los iones también desempeñan un papel importante en el uso del ATP que alimenta nuestras células.
Una versión mutante del ribosoma L22 en algunos Bacillus subtilis protege a la cepa contra los antibióticos y se une firmemente al átomo de magnesio cargado, dejando menos ATP para utilizar en la producción de energía celular. El modelo de Moon y su equipo reveló que este efecto fisiológico impide la capacidad de la cepa mutada de crecer y propagarse, en comparación con la B. subtilis no mutada .
«La competencia intracelular por una reserva finita de magnesio puede así suprimir el establecimiento de una variante de ribosoma resistente a los antibióticos», escriben los investigadores en su artículo.
Esto significa que sin la presión de los antibióticos, la B. subtilis no mutada es más apta que la B. subtilis resistente a los antibióticos .
«Demostramos que a través de una mejor comprensión de las propiedades moleculares y fisiológicas de las bacterias resistentes a los antibióticos, podemos encontrar nuevas formas de controlarlas sin el uso de medicamentos», explica Süel .
Una comparación limitada reveló que no todas las variantes de ribosomas mutados tienen esta debilidad, por lo que los investigadores están interesados en explorar mecanismos similares en otras bacterias también.
«Esperamos que nuestro trabajo pueda ayudar a identificar las condiciones que obstaculizan las cepas resistentes a los antibióticos sin requerir el desarrollo de nuevos antibióticos», concluyen Moon y su equipo .
Esta investigación fue publicada en Science Advances.












